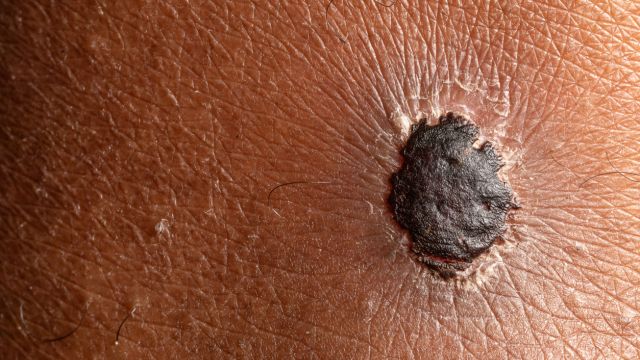
Меланома – злокачественное заболевание, возникающее в результате трансформации меланоцитов. Меланоциты возникают из нервного гребня во время эмбрионального развития. Таким образом, меланома, хотя чаще всего поражает кожу, может развиваться и в других местах миграции клеток нервного гребня. Встречается в коже, реже в глазах, мозговых оболочках и слизистых оболочках.
Заболеваемость первичной меланомой кожи неуклонно растет на протяжении нескольких десятилетий и остается самой смертоносной формой рака кожи. При диагностике на ранних стадиях пациенты с меланомой имеют высокую выживаемость, примерно 94%.
Меланомы слизистой оболочки и глаз обычно имеют худший прогноз. Резкое улучшение качества жизни и общей выживаемости пациентов с метастатической меланомой произошло с появлением различных новых комбинаций таргетной терапии и различных методов иммунотерапии.
Меланома отличается от немеланомного рака кожи тем, что она распространяется локально, регионально и отдаленно. Индивидуальный риск метастазирования напрямую связан с глубиной инвазии и изъязвления первичного очага.
Каковы причины его появления?
Трансформация нормальных меланоцитарных клеток в клетки злокачественной меланомы сопровождается сложным нарушением молекулярной передачи сигналов. Это приводит к усилению автономной пролиферации клеток, нарушению регуляции выживаемости клеток (апоптотическая резистентность), а также к повышенной инвазивности.
Причин развития меланомы множество. Семейный анамнез наблюдается у 5–10% пациентов с меланомой. Риск развития меланомы в 2,2 раза выше, если есть хотя бы один больной член семьи. Современное понимание молекулярного патогенеза меланомы основано на наблюдении, что около 10% всех меланом передаются в семьях, что убедительно свидетельствует о генетическом происхождении заболевания.
Несколько исследований показали, что почти от 40% до 50% меланом кожи имеют мутации в BRAF, серин/треонин-протеинкиназе, связанной с путем RAS-RAF-MEK. Мутация BRAF активирует путь митоген-активируемой протеинкиназы (MAP), который начинается на поверхности клетки и передает сигнал через RAS, затем RAF, за которым следует митоген-активируемая протеинкиназа (MEK) и киназа, регулируемая внеклеточными сигналами (ERK). ERK — последний белок в этом каскаде, который влияет на экспрессию генов в ядре и приводит к пролиферации клеток. Наиболее распространенной мутацией является V600E, хотя в некоторых случаях обнаруживалась и другая мутация, называемая V600K.
Наиболее установленным экзогенным фактором риска развития меланомы является воздействие ультрафиолетового излучения. Чем ближе человек находится к экватору и чем выше высота, на которой он живет, тем больше риск развития меланомы. Более того, эпидемиологические исследования показали, что повторяющиеся солнечные ожоги в детстве связаны с особенно высоким риском развития меланомы в дальнейшей жизни. Недавние данные свидетельствуют о том, что не только UVB-излучение, но и UVA-излучение может увеличить риск развития меланомы.
Светлая кожа, голубые глаза, светлые или рыжие волосы, солнечные ожоги в анамнезе, доброкачественные или диспластические меланоцитарные невусы в анамнезе, при этом количество поражений демонстрирует более сильную корреляцию, чем размер, а также ослабленный иммунитет являются известными факторами высокого риска.
Дополнительным фактором риска развития меланомы является количество выявленных доброкачественных меланоцитарных невусов: более 50 невусов в 4,8 раза выше риска по сравнению с пациентами, имеющими менее 10 невусов.
Люди с большим количеством диспластических невусов (более 5) также подвергаются повышенному риску развития меланомы, особенно если у них есть семейный анамнез меланомы (синдром диспластических невусов). Однако только около 30–40% меланом развиваются в сочетании с клинически существующим меланоцитарным невусом. Даже у пациентов с множественными меланоцитарными невусами большинство меланом развиваются de novo на ранее клинически незаметной коже.
Более низкий социально-экономический статус может быть связан с более поздней стадией заболевания на момент обнаружения. Несколько исследований пациентов с впервые диагностированным заболеванием показали, что у пациентов с низким социально-экономическим статусом снижается восприятие риска меланомы, знания о болезни и профилактические методы.
Клинические проявления и виды
Меланомы обычно выглядят как разноцветные (коричневые, черные, красноватые, сине-серые, белые, асимметричные и неравномерные) опухоли. Иногда пигментация может отсутствовать. Различия в размере опухоли, цвете и наличии вторичных высолов, таких как экссудация, образование корок, эрозии, изъязвления или регрессивные изменения, обуславливают чрезвычайное морфологическое разнообразие.
Меланомы традиционно подразделяют на клинические подтипы. Наиболее распространены среди европеоидов:
- Поверхностно распространяющаяся меланома (60–70%);
- Узловая меланома (15–30%);
- злокачественная меланома лентиго (5–15%);
- Акрально-лентигинозная меланома (5–10%).
Встречаются также многие другие виды меланомы — меланома слизистой оболочки, амеланотическая меланома, десмопластическая меланома, полипоидная меланома, веррукозная меланома, злокачественный голубой невус, дермальная меланома, меланома глаза и другие. Каждый тип имеет характерную клиническую особенность и гистологическую картину.
Что нового в терапии?
В терапии меланомы участие многопрофильной команды выгодно пациенту для определения правильных статей и лечения. В нем обычно принимают участие дерматолог, гистопатолог, онколог, хирург, лучевой терапевт.
Меланомы, диагностированные на более ранних стадиях, лечат преимущественно хирургическим вмешательством, заключающимся в иссечении опухоли методом широкого локального иссечения. Кроме того, проводится биопсия сторожевого лимфатического узла. В случаях, когда первичное закрытие невозможно из-за крупных поражений, требуются методы трансплантации кожи или трансплантации тканей. Обычно выполняют широкое местное иссечение до мышечной фасции.
Биопсия сторожевых лимфатических узлов рекомендуется пациентам с меланомой, у которых повышен риск метастазов в регионарные лимфатические узлы. Ингибиторы PD-1 одобрены для адъювантного лечения удаленной меланомы. В случае мутации BRAFV600 адъювантная терапия комбинацией ингибиторов BRAF/MEK является еще одним вариантом для пациентов с удаленной меланомой.
В 2015 году талимоген лагерпарепвек (T-VEC) был одобрен в качестве первой онколитической вирусной терапии для пациентов с поздней стадией меланомы, которую невозможно полностью удалить хирургическим путем. Его вводят непосредственно в кожу, мягкие ткани или опухоли лимфатических узлов.
В случае метастазов в первую очередь следует рассматривать хирургическую резекцию, которая может улучшить общую выживаемость. Если операция невозможна или нецелесообразна, показана медикаментозная терапия. При наличии мутации BRAF-V600 используются доступные ингибиторы (ингибиторы BRAF) и ингибиторы MEK.
Лучевая терапия представляет собой локализованное лечение и может применяться при слишком распространенной меланоме, когда невозможно оперировать или после операции, а также может использоваться в качестве комбинированной терапии. Лучевую терапию следует рассматривать у пациентов с метастазами, которые не ответили на системную терапию. Это также может помочь облегчить симптомы.
Ссылки:
1. Лечение меланомы (PDQ®). (2025, 2 мая). Cancer.gov. https://www.cancer.gov/types/skin/hp/melanoma-treatment-pdq
2. Хайстейн Дж. Б., Ачарья У. и Муккамалла СКР (17 февраля 2024 г.). Злокачественная меланома. StatPearls — Книжная полка NCBI. https://www.ncbi.nlm.nih.gov/books/NBK470409/
3. ДермНет. (2023b, 11 июля). Меланома. ДермНет®. https://dermnetnz.org/topics/melanoma